Lagunas cerebrales isquémicas - infartos lacunares
Última edición el : 22/09/2024
Una laguna cerebral se define anatomopatológicamente como una cavidad de menos de 15 mm de diámetro (algunos autores utilizan un punto de corte diferente), localizada en el parénquima cerebral profundo y vascularizada por una arteria perforante intracerebral (ganglios basales, tálamo, centro semioval, tronco encefálico). Las lagunas cerebrales isquémicas o infartos lacunares reflejan una necrosis secundaria a una falta crítica de aporte de oxígeno, y representan una forma particular de ictus isquémico.
Más raramente, las lagunas cerebrales pueden ser hemorrágicas, aunque esto suele reflejar el mismo tipo de microangiopatía que las lagunas isquémicas, o pueden confundirse con una dilatación de los espacios perivasculares, sin significado patológico demostrado.
En la práctica clínica, su diagnóstico se basa en una combinación de argumentos clínicos y, hoy en día, de forma decisiva en la resonancia magnética.
Clasificación y anatomía patológica
Clásicamente, existen tres tipos histológicos de lagunas cerebrales:
- Infartos lacunares - se cree que representan el 25% de los accidentes cerebrovasculares isquémicos
- Constituyen la mayoría de las lagunas cerebrales y se observan en el 6 al 11% de las autopsias (pero más del 80% de las lesiones se consideraron asintomáticas).
- Resultan de la oclusión de una arteria perforante (diámetro inferior a 400 μm, terminal, no anastomosada: lenticuloestriada desde las arterias cerebrales anterior y media, talamoperforante desde las arterias cerebrales posteriores, paramediana desde el tronco basilar).
- Causas principales: aterosclerosis de la arteria que da origen a la arteria perforante, lipohialinosis, etc.
- Lagunas hemorrágicas (presencia de hemosiderina en los macrófagos, lo que indica antecedentes de hemorragia)
- No siempre es posible diferenciarlas radiológicamente de las lagunas isquémicas. En caso necesario, pueden utilizarse secuencias de resonancia magnética cerebral T2* para identificar los depósitos de hemosiderina.
- Dilataciones de Virchow-Robin de los espacios perivasculares
- Redondeadas, regulares, a menudo contienen segmentos de arterias normales. A veces son difíciles de diferenciar de las lagunas isquémicas o hemorrágicas, y su diagnóstico correcto depende principalmente del grado de experiencia del radiólogo.
- Su origen e importancia clínica son controvertidos, y actualmente la mayoría de los médicos las consideran variantes anatómicas sin carácter patológico. En cualquier caso, dado que su descubrimiento aislado no tiene implicaciones terapéuticas, su lugar en esta clasificación es discutible.
Muchos autores, sin embargo, reservan el término lagunas para los infartos lacunares, refiriéndose a las "lagunas hemorrágicas" como microhemorragias (o microsangrados). Sea como fuere, los infartos lacunares y las microhemorragias representan con frecuencia dos caras de un mismo síndrome microangiopático.
Elementos de fisiopatología
Las lagunas cerebrales son una manifestación de las microangiopatías, ya sean localizadas o difusas. Durante mucho tiempo, además de los factores de riesgo cardiovascular clásicos, se ha sospechado que una serie de factores (inflamación sistémica, disfunción endotelial, trastornos de la hemostasia, etc.), cuyas funciones patogénicas se han establecido claramente, desempeñan un papel más decisivo que en los accidentes cerebrovasculares derivados de macroangiopatías. Sin embargo, en la actualidad no se ha demostrado ninguna diferencia significativa a este respecto.
Etiologías y factores de riesgo
Los factores de riesgo (tabaquismo, alcoholismo, obesidad, diabetes, hipertensión arterial, edad, hiperlipidemia) y las etiologías (véanse los capítulos correspondientes) son los mismos que en los ictus no lacunares. Sin embargo, el predominio de las etiologías difiere.
Lipohialinosis de las arterias perforantes (causa claramente predominante)
La lipohialinosis arterial corresponde al engrosamiento de la pared vascular por una sustancia hialina, lipídica y necrosis fibrinoide → pérdida de la arquitectura parietal vascular. Como su frecuencia es inversamente proporcional al calibre arterial, es bastante específica de los infartos lacunares. Su patogenia sigue siendo objeto de debate (¿alteración de la autorregulación a las variaciones de la presión arterial debida a una vasoconstricción crónica secundaria a una hipertensión crónica? ¿Susceptibilidad genética? ¿Mecanismos inflamatorios? Otros).
Los factores de riesgo son los mismos que para todas las vasculopatías, pero el riesgo relativo es significativamente mayor para la hipertensión arterial y la diabetes.
Angiopatías cerebrales amiloides
Las angiopatías amiloides cerebrales son un grupo heterogéneo de angiopatías caracterizadas por la presencia de depósitos de proteína amiloide en las paredes de los vasos cerebrales. Son frecuentes en pacientes de edad avanzada y contribuyen tanto a la isquemia cerebral como a la hemorragia.
Ateromatosis y aterosclerosis
La formación de lesiones estenosantes en placas ateromatosas, en las que intervienen los factores de riesgo cardiovascular clásicos, también afecta a las perforantes y se cree que es la segunda causa de infartos lacunares.
Dado que la esclerosis no afecta a arterias del mismo calibre que las perforantes cerebrales, sólo está implicada en los infartos lacunares resultantes de la oclusión de la conexión de las perforantes con arterias de mayor calibre.
CADASIL
La arteriopatía cerebral autosómica dominante con infartos subcorticales y leucoencefalopatía (CADASIL) es una enfermedad genética autosómica dominante (mutación del gen Notch 3, cromosoma 19) que afecta a las arterias pequeñas.
Características clínicas: migrañas con aura, accidentes cerebrovasculares isquémicos iterativos (2/3 síndromes lacunares), trastornos del estado de ánimo, demencia de aparición tardía. No existe un tratamiento específico.
Otros trastornos genéticos
Se han implicado otras enfermedades genéticas excepcionales en la génesis de los infartos lacunares múltiples: CARASIL (Cerebral Autosomal Recessive Arteriopathy with Subcortical Infarcts and Leukoencephalopathy), Biswanger-like, etc.
Varios
También se han descrito otras causas (véase etiologías de los accidentes cerebrovasculares isquémicos y hemorrágicos), como microembolias, coagulopatías, vasculitis infecciosas o no infecciosas, etc.
Clínica de la fase aguda
La mayoría de los infartos y hemorragias lacunares son silentes, aunque su acumulación puede conducir a un deterioro cognitivo progresivo e incluso al desarrollo de un estado multilacunar (ver evolución). Cuando se presentan sintomáticamente, su diagnóstico presupone por definición la ausencia de signos corticales, y se describen clásicamente ciertos cuadros que son más frecuentes que en otros tipos de ictus y se denominan "síndromes lacunares", aunque no son patognomónicos:
- Hemiplejia o hemiparesia motora pura
- Los más frecuentes. En la mayoría de los casos afecta al menos al miembro inferior y al superior, o a un miembro y a la cara.
- Afecta a la cápsula interna en 2/3 de los casos. Otras: protuberancia, corona radiata, pedúnculos cerebelosos, bulbo.
- Hemidéficit sensitivo-motor
- No asociado clásicamente a los síndromes lacunares, los avances en imagen han demostrado que se trata del segundo síndrome más frecuente. Regiones afectadas en orden decreciente de frecuencia: brazo posterior de la cápsula interna, corona radiata, rodilla de la cápsula interna, tálamo, brazo anterior de la cápsula interna.
- Hemideficiencia sensorial pura
- Poco frecuente (puede estar infradiagnosticado debido a alteraciones sensoriales aisladas poco sugestivas), generalmente reflejo de infartos muy pequeños.
- Hemiparesia atáxica
- Incluye dos síndromes "clásicos": "ataxia y paresia crural homolateral" y "disartria - mano torpe".
- Estos síndromes afectan generalmente a lesiones protuberantes.
- Síndrome de alerta capsular
- El "síndrome de alerta capsular" es una forma particular de accidente isquémico transitorio (AIT) que se caracteriza por la repetición a intervalos cortos de déficits hemicorporales motores o sensitivo-motores idénticos de corta duración. La progresión es frecuentemente hacia un infarto en la región capsuloestriada, y excepcionalmente en el tronco cerebral.
- Diversas presentaciones son de raras a excepcionales, aunque a veces muy sugestivas (como la aparición súbita y aislada de movimientos involuntarios de tipo hemicorea o hemibalismo en un paciente con factores de riesgo cardiovascular, frecuentemente confundidos con crisis epilépticas parciales en los servicios de urgencias).
Evolución
La mortalidad a corto plazo es baja (2% frente a 10 a 20% para los infartos no lacunares a 1 mes, 8% frente a 20% a 1 año) y a 5 años es del 25% (esencialmente debida a patologías cardiacas con la misma fisiopatología).
El pronóstico funcional también es mejor, con la excepción del deterioro cognitivo, y el riesgo de recurrencia es menor a corto plazo (0 a 4% en 1 mes frente a 5% para los infartos no lacunares, 5 a 8% frente a 10% a 1 año) pero similar a largo plazo.
Su acumulación rara vez se traduce en déficits motores graves, pero frecuentemente en el desarrollo o empeoramiento de trastornos cognitivos (11% de las demencias vasculares o mixtas a los 2 años, 15% a los 9 años) o incluso en un "estado multilacunar" (trastornos cognitivos, trastornos de la marcha a menudo de tipo praxia [= astasia-abasia], signos frontales, síndrome pseudobulbar).
Su presencia también se correlaciona con un mayor riesgo de hemorragia intraparenital (HIP), ++ profundo y tronco cerebral, que a veces puede incluso predominar en el lado isquémico de la enfermedad.
Pruebas complementarias
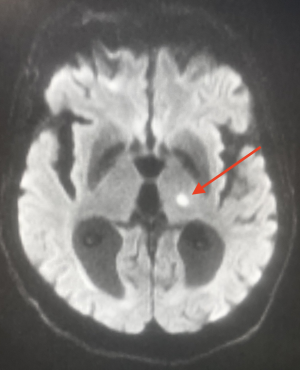
El estudio complementario es el de un ictus isquémico.
Características radiológicas específicas
En la TC cerebral, las lagunas pueden no aparecer o aparecer como hipodensidades ovales < 15 mm de diámetro.
La RM sigue siendo el examen de referencia y puede revelar :
- Lagunas antiguas: hiper en T2, hipo en T1. Difícil de diferenciar de los espacios perivasculares de Virchow-Robin (en este último caso, la lesión es más redondeada con bordes más regulares. La topografía a veces ayuda) incluso para los examinadores experimentados.
- Lagunas recientes: hiper en T2 y FLAIR.
- Fase aguda: mismas anomalías de difusión y de ADC que para otros tipos de ictus (hiper en difusión e hipo en ADC para un infarto).
- Coexistencia con otras anomalías:
- Probablemente relacionadas con los mismos mecanismos. Por ejemplo, demostración de microsangrados (secuencias T2*) o leucopatía vascular (zonas isodensas en TC, hiperintensas en T2 y FLAIR).
- Relacionado con otros mecanismos. Por ejemplo, es frecuente la coexistencia de macrosangrados y microsangrados corticales, que a menudo indican angiopatía amiloide.
Manejo terapéutico - Tratamientos
Las recomendaciones para el tratamiento son similares a las de otros tipos de ictus isquémico o hemorrágico (véanse los capítulos correspondientes). Sin embargo, hay que hacer algunas puntualizaciones específicas sobre las lagunas isquémicas:
- En el contexto agudo, no se ha demostrado que los beneficios y los riesgos (hemorragia secundaria) de la trombólisis IV (aunque menos significativos en términos teóricos) difieran de los de otros accidentes cerebrovasculares isquémicos. A la espera de nuevos datos, la naturaleza lacunar de un infarto no debería, por tanto, llevar a rechazar a un paciente para la trombólisis. Sólo podemos prestar especial atención a estos casos.
- A diferencia de otros infartos isquémicos, se ha demostrado que la doble antiagregación plaquetaria aumenta significativamente la mortalidad a largo plazo y no debe utilizarse. En cambio, se ha demostrado que la antiagregación plaquetaria con un solo agente reduce globalmente la morbilidad y la mortalidad (esto debe sopesarse con el riesgo del posible aspecto hemorrágico de la enfermedad). Por lo tanto, sólo podemos recomendar la prescripción de un antiagregante plaquetario (por ejemplo, ácido acetilsalicílico 160 mg/día) caso por caso.
También hay que tener en cuenta que, en la mayoría de los casos, la microangiopatía afecta a otros órganos, en particular la retina y el riñón, y/o se asocia a una macroangiopatía.
Bibliografía
Arboix A et al., Clinical characteristics of acute lacunar stroke in young adults, Expert Rev Neurother, 2015
Benavente OR et al., Clinical-MRI correlations in a multiethnic cohort with recent lacunar stroke: the SPS3 trial, Int J Stroke, 2014 Dec;9(8):1057-64
Caplan RL, Caplan's Stroke. A clinical approach, 4th ed, Saunders, 2009
Dhamoon MS et al., Long-term disability after lacunar stroke: secondary prevention of small subcortical strokes, Neurology, 2015 Mar 10;84(10):1002-8
Jauch EC et al., Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association, Stroke, 2013 Mar, 44(3):870-947
Kwok CS et al., Efficacy of antiplatelet therapy in secondary prevention following lacunar stroke: pooled analysis of randomized trials, Stroke, 2015 Apr;46(4):1014-23
Latchaw RE et al., Recommendations for Imaging of Acute Ischemic Stroke. A Scientific Statement From the American Heart Association, Stroke, 2009, 40:3646-3678
Meschia JF et al., Guidelines for the primary prevention of stroke: a statement for healthcare professionals from the American Heart Association/American Stroke Association, Stroke, 2014 Dec, 45(12):3754-832
Mok V et al., Prevention and Management of Cerebral Small Vessel Disease, J Stroke, 2015 May;17(2):111-22
Osborn AG, Diagnostic imaging : brain, Amirsys, USA, 2d ed., 2009
Sharma M et al., Predictors of mortality in patients with lacunar stroke in the secondary prevention of small subcortical strokes trial, Stroke, 2014 Oct;45(10):2989-94
Valdés Hernández MD et al., A comparison of location of acute symptomatic vs. 'silent' small vessel lesions, Int J Stroke, 2015 Jun 29
Wiseman S et al., Blood markers of coagulation, fibrinolysis, endothelial dysfunction and inflammation in lacunar stroke versus non-lacunar stroke and non-stroke: systematic review and meta-analysis, Cerebrovasc Dis, 2014;37(1):64-75
Yoshimura S et al., Cerebral Small-Vessel Disease in Neuro-Behçet Disease, J Stroke Cerebrovasc Dis, 2015 Jun 26