Gliomas de alto grado
Última edición el : 26/09/2024
Gliomas de alto grado (grados III y IV) son tumores malignos primarios del sistema nervioso central que se originan en las células gliales. Incluyen astrocitomas anaplásicos, oligodendrogliomas anaplásicos y glioblastomas. El más común en adultos es el glioblastoma multiforme (el glioma de grado IV más agresivo), con una incidencia de aproximadamente 5 casos por cada 100,000 habitantes por año.
A pesar de su potencial metastásico extremadamente bajo, su pronóstico vital lamentablemente sigue siendo sombrío a corto y medio plazo, con una supervivencia media con tratamiento de 30 meses para el grado III y de 10 a 15 meses para el grado IV (supervivencia a 5 años del 5 al 10%).
Elementos Histológicos y de Oncogénesis
Si bien el diagnóstico histológico de glioma de alto grado es generalmente sencillo (carácter glial confirmado por anticuerpos GFAP, grado de malignidad evaluado según criterios estándar: número de mitosis, núcleos anormales, grado de necrosis, proliferación endotelial), sus clasificaciones (clasificación histológica de la OMS o clasificación histo-radiológica de Sainte-Anne) siguen siendo imprecisas y poco reproducibles. Además, algunos gliomas de grado III se parecen mucho a gliomas de grado II (tradicionalmente clasificados como "gliomas de bajo grado" aunque ahora también se consideran lesiones malignas verdaderas) debido a su evolución clínica y apariencia radiológica más favorables. La opinión del patólogo debe compararse, por lo tanto, con los resultados de la imagen radiológica e isotópica.
En cualquier caso, la OMS distingue entre gliomas anaplásicos (grado III: astrocitomas anaplásicos, oligodendrogliomas y oligoastrocitomas) y glioblastomas (grado IV).
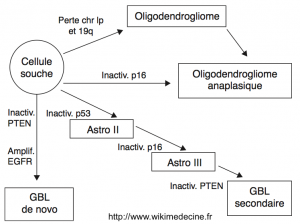
La oncogénesis se caracteriza por una proliferación de células gliales secundaria a la sobreexpresión de proto-oncogenes y la pérdida de supresores tumorales. Se han encontrado numerosas anormalidades citogenéticas (++ deleciones de 1p, 9p, 10, 13q, 17p, 19q, 22q y ganancias en el cromosoma 7), y su número está correlacionado con la agresividad del tumor.
La hipótesis histórica de que los glioblastomas solo surgen de novo ha sido abandonada, y ahora se establece bien que los gliomas de grado II progresan ineludiblemente a alto grado. Actualmente, se describen tres vías principales de progresión de las células gliales:
- Vía de astrocitomas de grado II → III (astrocitoma anaplásico) → IV (glioblastoma secundario)
- Los gliomas de grado II degeneran inevitablemente a grado III y luego a grado IV como resultado de la acumulación de alteraciones genéticas caracterizadas por mutaciones tempranas de p53 y un bucle autocrino de PDGF/PDGFR. Se encuentran mutaciones o deleciones de p16 y CDKN2A en focos anaplásicos. La progresión a glioblastoma estaría vinculada a la aparición de deleciones del cromosoma 10 y la hipermetilación de regiones promotoras de RB1 y MGMT.
- Vía de glioblastomas "de novo" = primarios
- Su ocurrencia se caracteriza por la amplificación de EGFR, pérdida del cromosoma 10, mutación de PTEN y amplificación de MDM2. Las mutaciones de p53 son raras.
- Vía de oligodendrogliomas (grado II) → oligodendrogliomas anaplásicos
- Alta frecuencia de deleción heterocigota de 1p y 19q, bucle autocrino de PDGF/PDGFR. La degeneración anaplásica estaría acompañada por la pérdida de p16/CDKN2A, 10q, RB1 y p53, y sobreexpresión de EGFR.
En la gran mayoría de los casos, no hay antecedentes familiares de tumores cerebrales. Los casos que ocurren dentro del marco de síndromes tumorales hereditarios (síndrome de Li-Fraumeni, síndrome de Lynch, etc.) son la excepción.
Varios factores de riesgo ocupacionales (industria del caucho, plomo, pesticidas) han sido implicados, aunque no se ha demostrado un vínculo causal directo. Sin embargo, al igual que con los meningiomas, están bien establecidos los casos de gliomas de alto grado inducidos por radiación.
Clínica
Las manifestaciones clínicas pueden incluir:
- Debido a la lesión misma (infiltración, compresión, sesgo vascular)
- Convulsiones (20 a 50% de los pacientes)
- Déficits focales que varían según la ubicación y de aparición progresiva
- Cefaleas (estiramiento de elementos vasculares o meníngeos)
- Debido a hipertensión intracraneal (HTIC)
- Cefaleas (++ mañanas, bilaterales, punzantes, que empeoran con cambios de posición o maniobra de Valsalva), náuseas, vómitos, raramente disminución de la agudeza visual debido a edema de papila (más frecuente en niños)
- Repercusiones sistémicas
- Mecanismo no explicado (¿trastornos metabólicos y/o inmunológicos? funcionales?)
- Asténia, disminución de la libido, ansiedad
Aunque pueden ocurrir a cualquier edad, los astrocitomas anaplásicos ocurren preferentemente entre los 25 y 34 años, mientras que los glioblastomas de novo ocurren preferentemente entre los 65 y 74 años.
Generalmente se presentan con déficits neurológicos focales progresivos rápidamente y/o convulsiones recurrentes.
Excepto por diseminaciones dentro del parénquima cerebral y espinal o líquido cefalorraquídeo (LCR) (gliomatosis meníngea, que ocurre en 4 a 20% de los casos), el potencial metastásico de estos tumores es extremadamente bajo. Sin embargo, se han descrito casos de metástasis óseas o pleurales.
Exámenes Complementarios
Tomografía Computarizada cerebral sin y con contraste
Puede revelar calcificaciones, cambios hemorrágicos, un efecto de masa,… La lesión y el edema generalmente aparecen como un área hipodensa. La captación de contraste indica una ruptura de la barrera hematoencefálica (BHE). A veces, el diagnóstico diferencial puede ser difícil con un accidente cerebrovascular, encefalitis, absceso o metástasis.
Resonancia Magnética cerebral con gadolinio (Estándar de Oro)
En astrocitomas de grado III, generalmente se observa un hiposeñal difusa en T1 (lesión + edema), áreas que realzan con gadolinio que corresponden principalmente a zonas de transformación anaplásica, un hiperseñal difusa en FLAIR y T2.
En glioblastomas, se observa típicamente una gran lesión hipointensa muy heterogénea en T1, que a menudo toma contraste de manera heterogénea (+ a veces captación de contraste anular) y es hiperintensa en T2, con múltiples cambios hemorrágicos y un gran edema perilesional. A diferencia de los linfomas y abscesos, las áreas necróticas son típicamente frecuentes (hiperseñales T2 y FLAIR), la perfusión está aumentada (neovascularización), y generalmente no hay restricción de difusión (sensibilidad y especificidad del 90%).
A veces se observan lesiones expansivas más pequeñas a distancia (gliomas multicéntricos), una vasta hoja de lesión que involucra varios lóbulos o incluso todo el cerebro (gliomatosis cerebral), o pachimenigitis (gliomatosis meníngea).
La espectroscopia por resonancia magnética es útil en diagnósticos radiológicos difíciles y para especificar el grado de malignidad del tumor.
Punción Lumbar
Su papel es muy limitado aquí. Puede tener interés en casos de pach meningitis → la anatomopatología del líquido cefalorraquídeo puede ayudar en el diagnóstico diferencial (gliomatosis meníngea, sarcomatosis meníngea, pach meningitis metastásica, sarcoidosis, infecciones crónicas). Sin embargo, a menudo está contraindicada debido al efecto de masa del tumor (riesgo de compromiso por descompensación de hipertensión intracraneal).
Anatomopatología: Biopsia Estereotáctica o Pieza Quirúrgica
Una confirmación anatomopatológica es esencial para el diagnóstico definitivo. Puede basarse en una biopsia o directamente en el producto de la exéresis quirúrgica si se retiene de inmediato una indicación operativa. Además de la confirmación diagnóstica, también permite análisis moleculares e histoquímicos que caracterizan la histología y genética del tumor para guiar mejor los tratamientos.
PET-Cerebral
- Con Metionina
- ++ para determinar el grado de malignidad del tumor
- Con FDG
- ++ para guiar una biopsia estereotáctica (hot spot), útil para el diagnóstico diferencial entre una recurrencia y una radionecrosis, puede ser útil para el diagnóstico diferencial con un linfoma.
SPECT-CT Cerebral con MIBI
Actualmente se utiliza principalmente para el diagnóstico diferencial entre recurrencia y radionecrosis.
Varios
Evaluación neuropsicológica sistemática +- oftalmológica. Discutir la realización de otros exámenes según el diagnóstico diferencial establecido.
Factores Pronósticos
De manera general, los factores de mal pronóstico (evolución más rápida) son: edad > 45 años, glioblastoma multiforme, resección quirúrgica incompleta basada en radiología, índice de rendimiento bajo.
El pronóstico sombrío de los gliomas de alto grado debe matizarse por el hecho de que un aumento en la supervivencia más significativo puede lograrse en algunos casos raros: algunos gliomas de grado III evolucionan de manera similar a los de grado II (hasta varias décadas, la apariencia radiológica es el mejor factor predictivo) y los tumores muy superficiales pueden permitir resecciones quirúrgicas iterativas óptimas.
Calidad de la Resección Quirúrgica
El beneficio en términos de calidad de vida depende de cada caso según la expresión clínica, la localización y los riesgos iatrogénicos. La resección total únicamente basada en lo macroscópico no ha demostrado ningún beneficio sobre la duración de la vida. Sin embargo, se ha demostrado un beneficio limitado (++ 8 a 14 semanas) en casos de resección óptima basada en MRI.
El beneficio es, sin embargo, a veces más importante para lesiones de localización superficial que permiten resecciones iterativas sencillas → la cirugía automática es absurda y siempre debe discutirse caso por caso. En su caso, preferir la resección de lesiones basada en macroscópico + radiológico.
Principios Terapéuticos - Tratamientos
La óptica es puramente paliativa, el beneficio esperado en términos de supervivencia debe sopesarse cuidadosamente con las repercusiones en términos de calidad de vida. Cada caso debe ser discutido, pero la gestión inicial más frecuente combina cirugía, radioterapia y quimioterapia.
Cirugía
La cirugía sigue siendo el estándar de oro. Sin embargo, obtener una "cura" es ilusorio: la "recurrencia" es inevitable, sea cual sea la calidad de la resección. Tres objetivos son posibles:
- Diagnóstico: anatomopatología diagnóstica a través de biopsia o exéresis – generalmente indispensable para definir el tratamiento posterior y eliminar con certeza un diagnóstico diferencial potencialmente curable.
- Aumentar la supervivencia y/o aliviar síntomas: reducción del volumen tumoral, evacuación de contenido quístico, liberación o derivación del líquido cefalorraquídeo.
- Potencializar el efecto de los tratamientos adyuvantes: resección de áreas poco vascularizadas, más resistentes a la quimioterapia y radioterapia.
La resección total basada en la radiología peroperatoria se prefiere. Sin embargo, debe equilibrarse el beneficio reducido sobre la duración de la vida con las posibles complicaciones postoperatorias según la localización. Por lo tanto, cualquier intervención debe discutirse cuidadosamente.
Radioterapia
Aumenta la mediana de supervivencia de todas las neoplasias cerebrales (globalmente, la ganancia de supervivencia se estima en 3 meses para los gliomas de alto grado). La radioterapia convencional adyuvante a la cirugía sigue siendo el estándar de oro. El gamma knife puede discutirse caso por caso.
En las semanas siguientes, puede observarse un agravamiento transitorio (edema). Un corticosteroide puede ser útil. Después de más de un mes, puede ocurrir un deterioro neurológico (desmielinización), generalmente transitorio y sin tratamiento posible. Después de más de 4 meses, se pueden encontrar radionecrosis, atrofia cerebral o trastornos del eje hipotálamo-hipofisario. Las encefalopatías post-radiante son generalmente demasiado tardías para ser encontradas en un contexto como este.
Quimioterapia
Aumenta la mediana de supervivencia en aproximadamente 2 meses. No hay diferencia demostrada entre la quimioterapia PO, IV o local peroperatoria. No hay consenso sobre el momento para iniciarla (¿lo más rápido posible? ¿reservado para recidivas?). Las moléculas que han demostrado eficacia son: BCNU, CCNU, fotemustina, cisplatino, carboplatino, procarbazina, etopósido, ciclofosfamida, hidroxiurea, bleomicina, temozolomida (++ en primera línea). También se pueden utilizar implantes de carmustina.
No hay consenso sobre los protocolos, pero aquí hay uno que ha demostrado su eficacia: temozolomida PO 75 mg/m²/día 1 hora antes de cada irradiación durante la radioterapia, tratamiento adyuvante un mes después de la radioterapia de 150 mg/m²/día durante 5 días cada 28 días (200 mg/m²/día a partir del segundo ciclo). Debe asegurarse la profilaxis anti-pneumocistis durante el tratamiento (por ejemplo, trimetoprim/sulfametoxazol 800/160 mg 3 veces/semana). La duración de la quimioterapia no está codificada (usualmente 6 ciclos).
Varios
Diversos enfoques, aún no validados, están en evaluación: agentes antiangiogénicos, agentes modificadores de los bucles autocrinos y paracrinos, inmunomoduladores, campos electromagnéticos alternativos.
En emergencias, y en caso de edema tumoral voluminoso, un corticosteroide puede tener un efecto transitorio espectacular (! a evitar al máximo hasta que se descarte el diagnóstico diferencial de linfoma).
Un tratamiento antiepiléptico debe iniciarse de forma permanente en caso de aparición de convulsiones. Sin embargo, no hay indicación para un tratamiento profiláctico (aunque a veces se instituye un tratamiento antiepiléptico temporalmente [1 a 3 meses] postoperatoriamente... no hay evidencia que apoye este enfoque). En cuanto a los glioblastomas, se ha sugerido durante varios años la potenciación del efecto de la temozolomida por el valproato... sin ningún beneficio demostrado en términos de supervivencia.
Bibliografía
Batchelor T, Initial postoperative therapy for glioblastoma and anaplastic astrocytoma, UpToDate, 2018
Batchelor T et al., Management of recurrent high grade gliomas, UpToDate, 2018
Bradley WG et al., Neurology in clinical practice, 5th ed., Butterworth-Heinemann, e-dition, 2007
Chatel M et al., Gliomes de haut grade, Encyclopédie Médico-Chirurgicale, Neurologie, Elsevier, Paris, 2005
Dietrich J et al., Clinical presentation, initial surgical approach, and prognosis of high grade gliomas, UpToDate, 2018
Osborn AG, Diagnostic imaging : brain, Amirsys, USA, 2d ed., 2009
Shih HA, Radiation therapy for high grade gliomas, UpToDate, 2018





